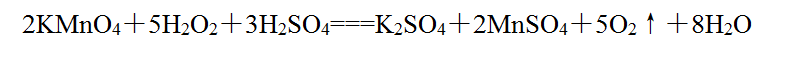臭氧
臭氧的分子式为O3,与 O2互为同素异形体。
常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,密度比氧气大,臭氧分子是一种弱极性分子,所以比氧气易溶于水。吸入少量臭氧对人体无害,吸入过量臭氧对人体健康有一定危害。
化学性质:
不稳定性:O3不稳定,容易分解。
2O3===3O2
在放电条件下空气中的O2可以转化为O3。
3O2 =(放电)2O3
强氧化性:O3的氧化性比O2更强,容易使淀粉-KI溶液变蓝色。
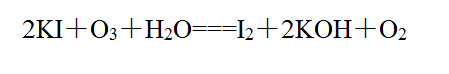
O3氧化性强,可将有机色素氧化,能使有色物质褪色,表现出漂白性。
用途:
可用作脱色剂和消毒剂,可用于饮用水的杀菌消毒;
臭氧层可以吸收来自太阳的紫外线,是人类和其他生物的保护伞,氟氯烃和氮氧化物能破坏臭氧层;
臭氧也是一种环境污染物。
过氧化氢
过氧化氢分子是极性分子,分子间可形成氢键,与水分子也可形成氢键,易溶于水,常温下是无色液体。
电子式:
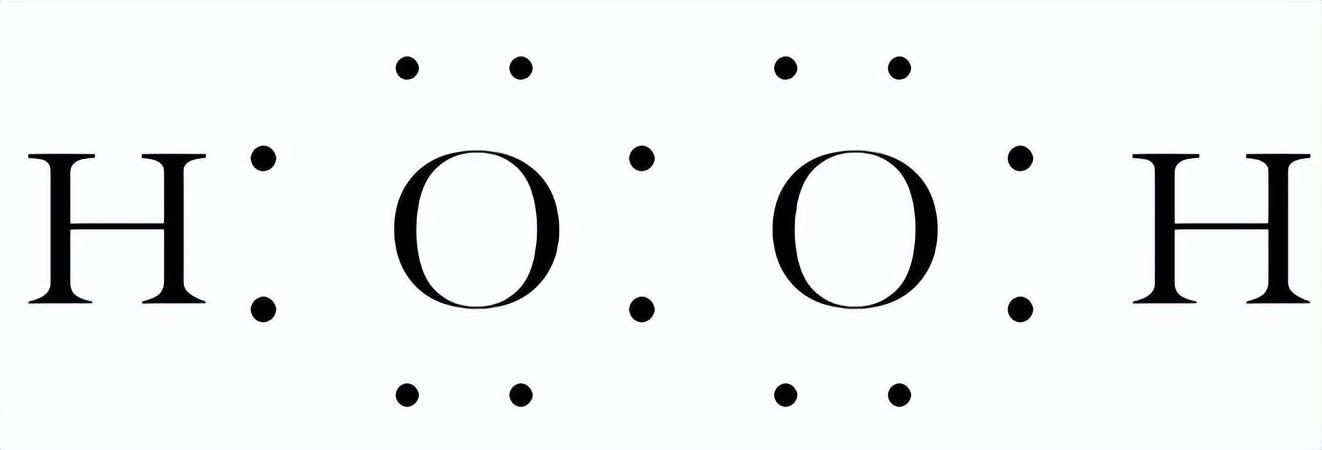
结构式:H—O—O—H。
化学性质:
过氧化氢不稳定,加热、光照或加催化剂都能加快其分解,应保存在棕色瓶中并放置在阴凉处。

有弱酸性,相当于二元弱酸。
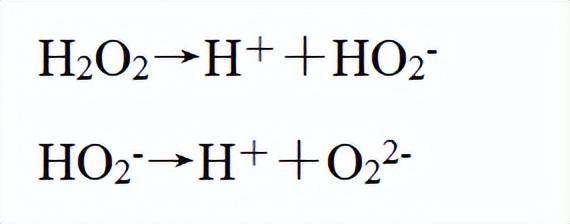
其-1价的氧有较强氧化性,其还原产物为水,不会带入新的杂质,所以称为“绿色氧化剂”:
①工业上用10%的H2O2作为漂白剂,医疗上用3%的H2O2作为消毒杀菌剂;
②氧化Fe2+、SO2等还原性物质;
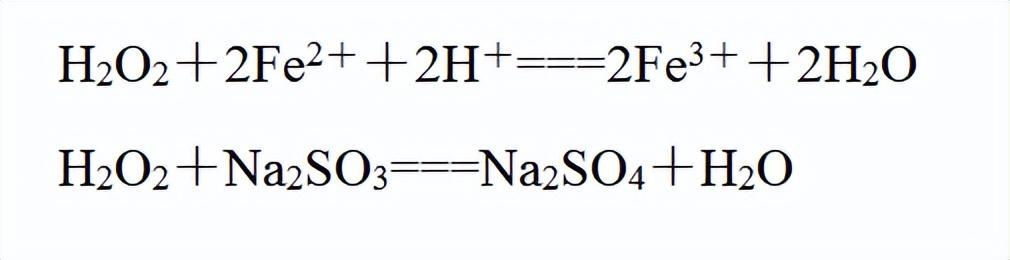
③使湿润的淀粉-KI试纸变蓝;
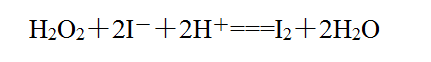
有弱还原性,H2O2中-1价的氧遇强氧化剂可失去电子转化成0价氧而被氧化,如与酸性KMnO4溶液反应: